Autores: Fernando William Moreira Santana (Mestrando PPIPA), Ludmilla Sousa Quirino (Graduanda em Biotecnologia), Sávio Gabriel Silva Rende (Graduando em Odontologia), Alessandro Sousa Corrêa (Doutorando PPIPA) e Vinícius José de Oliveira (Doutorando PPIPA).
A doença infecciosa COVID-19
ocasionada pelo novo coronavírus (SARS-CoV-2) é responsável por uma paralisação
mundial, e seus efeitos ultrapassam consequências na saúde, tendo repercussão
na realidade de bilhões de pessoas. Sendo um marco no ano de 2020, onde há uma
divisão no tempo de: antes e depois da pandemia do vírus. A infecção cuja
manifestação pode ser assintomática ou sintomática interrompeu mais de 800 mil
vidas até agosto de 2020 (Corbett et al,
2020). E embora nações tenham parado, a ciência foi mobilizada para produção do
que poderá ser o fim do isolamento: uma vacina.
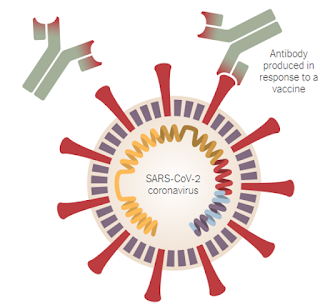
Figura
1: Estrutura representativa do
SARS-CoV-2 contendo anticorpo ligado à proteínas de superfície viral, sendo que
esses anticorpos podem ser produzidos pela imunização vacinal. Adaptado de The New York Times, 2020.
Dentre as inúmeras vacinas em
desenvolvimento em diferentes fases de estudo, algumas apresentaram promissoras
e já alcançaram a fase 3 (testes de eficácia, efetividade e segurança),
conforme a tabela abaixo:
Tabela
1: Exemplos de vacinas em fase 3 de
testes.
|
Vacina |
Instituição/País |
Estágio de desenvolvimento |
Abordagem |
|
mRNA-1273 |
Moderna, Estados Unidos |
Fase 3 |
Vacina de mRNA para produção de
proteínas virais |
|
CoronaVac |
Sinovac, China |
Fase 3 |
Inativação química do vírus |
|
-- |
Beijing Institute of Biological
Products |
Fase 3 |
Vírus inativado |
|
--- |
Wuhan Institute of Biological
Products e Sinopharm, China |
Fase 3 |
Partículas do vírus, inativação |
|
ChAdOx1 nCoV-19 |
Astra Zeneca e Oxford, Inglaterra
e Suíça |
Fase 3 |
Adenovírus modificado |
|
BNT162 |
Pfizer e BioNTech´, Alemanha e
Estados Unidos |
Fase 3 |
Vacina de mRNA |
|
BCG |
Murdoch Childrens Research
Institute, Austrália |
Fase 3 |
Bacilo de Calmette-Guérin (BCG) |
|
Ad5 |
CanSinoBio, China |
Fase 3 e aprovada para uso
limitado |
Adenovírus |
Uma delas, a vacina mRNA-1273, desenvolvida pela Moderna, está na fase 3 de testes e apresenta resultados positivos. Essa vacina consiste em um RNA mensageiro (mRNA) que codifica o antígeno S-2P, uma glicoproteína transmembrana do SARS-CoV-2, envolta por uma nanopartícula lipídica (Corbett et al, 2020). Em estudos pré-clínicos, 24 primatas não humanos foram utilizados para avaliar a resposta imune desencadeada pela vacinação. Os primatas foram separados em grupos para que houvesse a aplicação da vacina em doses variadas (10µg a 100µg), resultando na produção de anticorpos neutralizantes nesses animais (Corbett et al, 2020).
Ademais, na fase 1 e 2 de testes, aproximadamente 700 participantes de idades variadas foram separados em grupos e foi administrado doses variadas (25µg a 250µg) em cada grupo, sendo que os participantes apresentaram resposta imune anti-SARS-CoV-2 e não apresentaram reações adversas preocupantes (Jackson et al, 2020). A fase 3 já foi planejada e pretende testar a vacina em mais de 30.000 participantes.
Além disso, há a vacina inativada SARS-CoV-2 com hidróxido de alumínio desenvolvida pela Sinovac Life Sciences Co.,Ltd., intitulada como CoronaVac apresentou possíveis resultados de produção de anticorpos neutralizantes específicos em ensaios realizados em camundongos, ratos e primatas (Zhang et al, 2020). Em estudos na fase 2 apontou-se não haver reações adversas preocupantes, sendo a reação principal apenas dor no local da injeção. Também em ambas as dosagens 3µg e 6µg foi apresentada uma boa imunogenicidade e segurança, o que sustentou o início da realização dos ensaios da fase 3 pela escala/dosagem ótima em cenários diversos (Zhang et al, 2020).
Os testes foram realizados em
aproximadamente mil chineses na fase 1 e 2 da CoronaVac. Atualmente, na fase 3,
cerca de nove mil brasileiros foram testados em julho de 2020 no Instituto Butantã
em São Paulo. Segundo o próprio instituto, se a vacina demonstrar eficácia e
for aprovada, poderá ser produzida em larga escala e transferida para o Brasil
a fim de fornecimento gratuito pelo Sistema Único de Saúde (SUS).
Outra vacina que está na fase 3 do
processo de produção é a ChAdOx1 nCoV-19, popularmente conhecida como “vacina
de Oxford”. Um estudo publicado
recentemente demonstrou resultados positivos na imunização de participantes que
receberam as doses (Folegatti et al,
2020). Adultos entre 18 e 55 anos, sem histórico ou sintomas semelhantes de
COVID-19 receberam doses únicas da vacina (5 x10¹⁰ partículas virais), os quais serão monitorados por um
período de até um ano. Uma parcela pequena desse grupo recebeu uma segunda dose
após 28 dias da primeira.
Na
elaboração da estrutura da vacina foi utilizado o vírus ChAdOx1 (causador de resfriado comum em chimpanzés)
enfraquecido e modificado, com a inserção de um códon do SARS-CoV-2 responsável
pela expressão da proteína Spike encontrada na superfície viral. Foi
identificado que essa proteína é responsável pela interação do vírus com as
células humanas em função da alta reatividade com enzima conversora de
angiotensina encontrada na superfície da membrana plasmática (Folegatti et al, 2020).
O grupo controle do estudo recebeu a
vacina MenACWY por promover sintomas semelhantes ao da ChadOx1 nCov-19,
permitindo que todos os participantes tenham a mesma experiência pós vacinação.
É feito um acompanhamento minucioso por meio de um diário eletrônico,
acompanhamento semanal, coleta de fluidos e análise sérica dos participantes.
Resultados prévios demonstram um pico de aumento de células T em 14 dias após a
vacinação e aumento de anticorpos reativos após 28 dias (Folegatti et al, 2020).
Em suma, os esforços científicos
para o desenvolvimento de uma vacina contra o SARS-CoV-2 têm sido enormes, e
embora em tempo recorde, ainda não se tem uma tecnologia ou tratamento
específico comprovado e liberado para a população contra a doença. Desta forma,
o isolamento social e as medidas de higiene são vitais na preservação de vidas
e da saúde mundial.
REFERÊNCIAS BIBLIOGRÁFICAS
Global research on coronavirus disease (Covid-19). World Health Organization. Disponível
em:<https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov>.
Acesso em: 13 de agosto de 2020.



Nenhum comentário:
Postar um comentário